生物大分子药物是一类利用现代生物技术方法生产的源自生物体内并被用于疾病的诊断、治疗或预防的生物大分子,狭义上也被称为生物技术药物,如疫苗、抗体药物,包括单克隆抗体、抗体偶联药物(ADC)、双特异性抗体、Fc 融合蛋白、抗体片段、多克隆抗体等。与化学合成药物相比,生物大分子药物具有相对分子量大,结构复杂、不易透过生物膜、给药剂量低和易在体内降解等特点。随着生物技术的迅猛发展,生物大分子药物已被广泛用于治疗肿瘤、自身免疫性疾病和代谢性疾病等多种疾病。然而因此类药物生产技术和本身分子量较大等特点,大分子药物往往会出现免疫原(Immunogenicity)。
免疫原性(Immunogenicity)是当治疗类蛋白产品作为某些疾病的治疗药物时,被机体识别为外来物质(抗原)而产生的免疫应答。然而对于治疗性蛋白的这一免疫应答往往是不必要或非预期的,且在此应答过程中可导致机体产生抗药抗体(Anti-drug antibodies,ADAs),包括抗药抗体、中和抗体、免疫复合物等,ADA的存在可影响药物的生物学活性、药代动力学参数,甚至使得药物原有的疗效降低或缺失,而当有些免疫应答与机体内源性蛋白产生交叉免疫反应,则可能带来严重的临床安全问题。
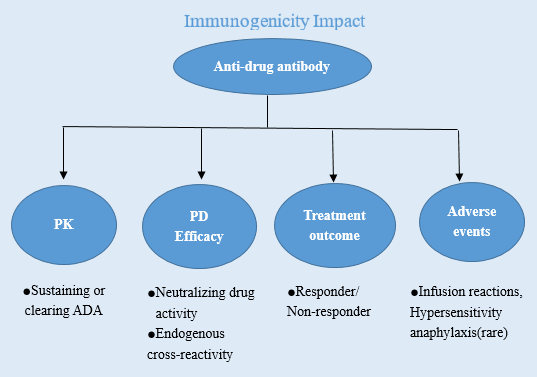
图一 免疫原性的影响
正是基于此, 免疫原性的评估亟需相关技术规范文件予以支持。
2007年欧洲药品监管机构(EMA)的人用药品委员会 (CHMP) 发布免疫原性评估的指导原则但并未对如何产生相应数据数据作出详细规定,在2017年EMA发布了该指导原则的最终版本(Final Version),但仍没有出现技术细节上的详细规定,EMA贯彻其适用目的原则(fit to purpose, FTP),要求申办方选择最优的方法来响应或满足监管要求,具有相对灵活性。
美国FDA则于2014年首次发布了免疫原性评估指导原则,其中给出免疫原性的影响因素和评价策略。并于2019年发布的免疫原性评估指导原则《Immunogenicity Testing of Therapeutic Protein Products —Developing and Validating Assays for Anti-Drug Antibody Detection Guidance for Industry 》中将“免疫原性”定义为治疗性蛋白产品对自身和相关蛋白产生免疫应答或诱发免疫相关临床不良事件的倾向。
国家药品监督管理局(NMPA)于2020年08月24日发布了《药物免疫原性研究技术指导原则(征求意见稿)》,并于2021年03月29日发布正式版本,其总体的评估策略与FDA相同,与已有的FDA和EMA指导原则有所不同,NMPA正式版则充分考虑到了非临床和临床研究中免疫原性检测方法的差别。这一指导原则的出台,为国内免疫原性相关研究提供了至关重要的规范性指导。
对于ADA的检测,NMPA、FDA、EMA的检测决策基本一致,三者均提倡多层级的评估策略:
(1)筛选试验:对所有样本进行,筛选出疑似阳性样品;
(2)确证试验:对疑似阳性样本进行特异性的确证试验,确定阳性样本;
(3)滴度试验:对已确定抗体阳性的样本进行滴度试验,确定阳性相对强弱;功能性试验对抗体进行中和活性检测。
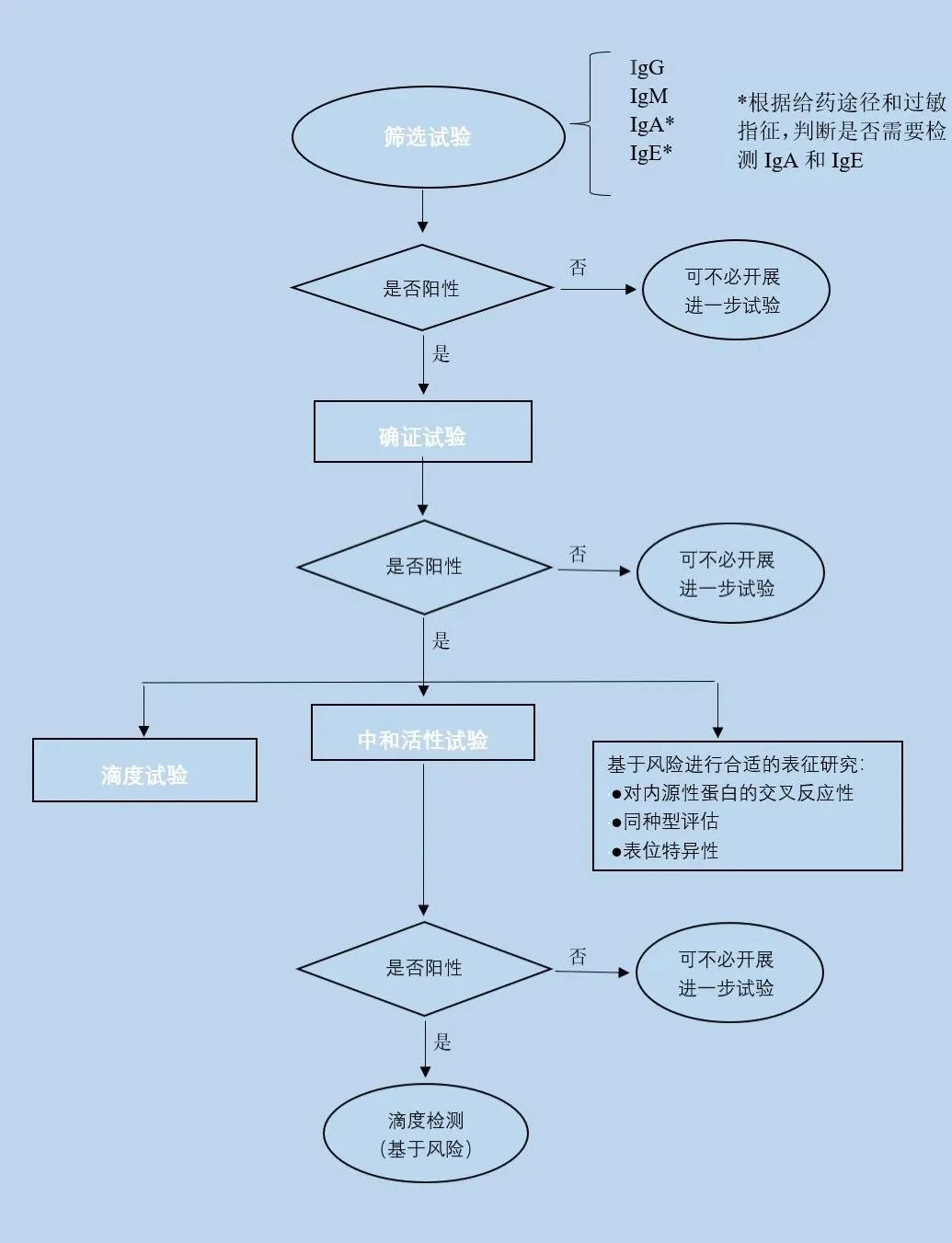
图二 ADA检测的分级评估策略
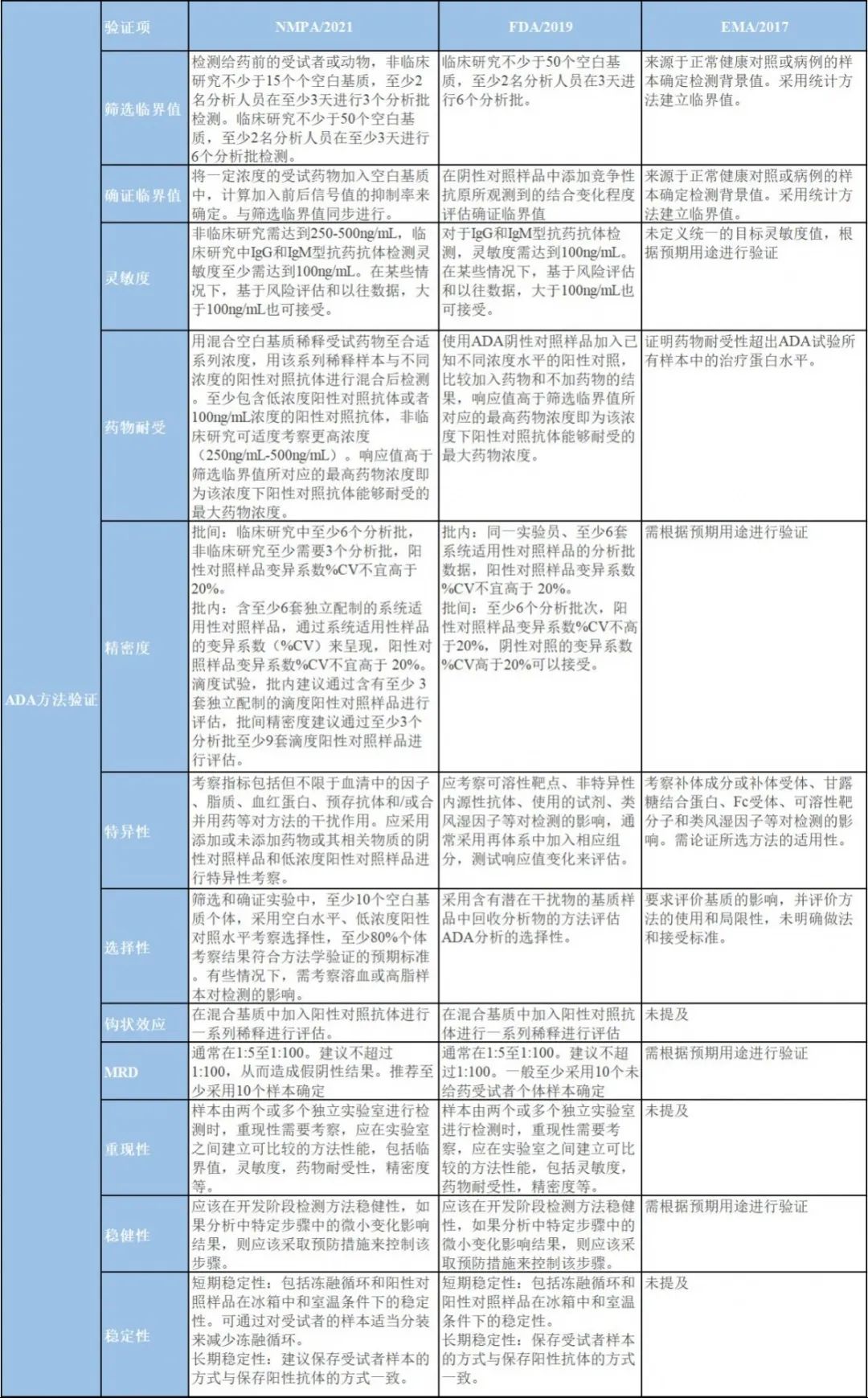
图三 NMPA、FDA、EMA指导原则中验证的内容和接受标准异同点
对于抗药抗体检测针对不同的检测需求和难度可以采用不同的方法和仪器,包含但不局限于:直接法、桥联法和均相结合法等。传统的检测仪器有酶标仪、MSD等,目前基于MSD(电化学发光) 平台的桥接法是ADA检测中最经典的方法。而在安徽万邦医药分析测试中心平台正拥有此类完善的检测设备和多年的生物分析经验,检测能力涵盖药代动力学(PK),药效学(PD),抗药抗体(ADA),中和抗体(NAb),和生物标志物(Biomarker)检测等,可根据客户需求提供完善的方法学开发、验证和生物样本检测服务,欢迎全国各地的朋友前来合作咨询。

参考资料
[1]《药物免疫原性研究技术指导原则(征求意见稿)》NMPA, 2020.08
[2]《药物免疫原性研究技术指导原则》,NMPA, 2021.03.
[3]Immunogenicity Testing of Therapeutic Protein Products — Developing and Validating Assays for Anti-Drug Antibody Detection Guidance for Industry, January 2019.
[4]Guide line on Immunogenicity assessment of biotechnology-derived therapeutic proteins (EMEA/CHMP/BMWP/14327/2006 Rev 1), 1st Dec 2017.
